Un simple changement d'acides aminés dans la séquence d'une protéine peut avoir de grandes conséquences sur la biologie d'un virus. Le SARS-CoV-2 mute constamment et certaines de ces mutations lui permettent d'améliorer sa fitness, c'est-à-dire sa capacité à se répliquer et à se propager. Le succès du mutant D614G en est un exemple.
au sommaire
Aux premières heures de la pandémie de coronavirus, les scientifiques chinois ont rapidement partagé la séquence génétique du premier SARS-CoV-2. Depuis, cette souche de Wuhan sert de génome de référence à l'étude des mutations accumulées par le virusvirus. Bien que les variants anglais, sud-africain et autres progressent rapidement, la souche majoritaire en Occident est toujours D614G. Par rapport à la souche de Wuhan, elle possède une mutation à la position 614 de la protéineprotéine S, un acide aspartiqueacide aspartique a laissé sa place à une glycineglycine. Un changement qui semble mineur mais qui a permis au mutant D614G de se substituer à la souche originelle.
Pour comprendre les raisons de son succès, les scientifiques ont étudié sa biologie lors d'expériences in vitroin vitro et in vivoin vivo, notamment sur des hamsters. Ces études, parues à la fin de l'année 2020 dans Nature et Science, sont parvenues à la même conclusion : la souche D614G est plus infectieuse, elle se réplique plus facilement dans les cellules humaines. Les hamsters infectés par D614G ont une charge viralecharge virale plus élevée et des anticorps neutralisants moins efficaces. Voilà comment une simple mutation a permis à une souche autrefois minoritaire de supplanter toutes les autres.
L'enjeu est désormais d'expliquer les origines de ces observations. Quels changements la mutation a-t-elle induits dans la structure de la protéine S ? Deux études sont parues récemment pour tenter d'élucider ce mystère. Elles apportent chacune une réponse différente.
Une mutation qui ouvre la protéine S
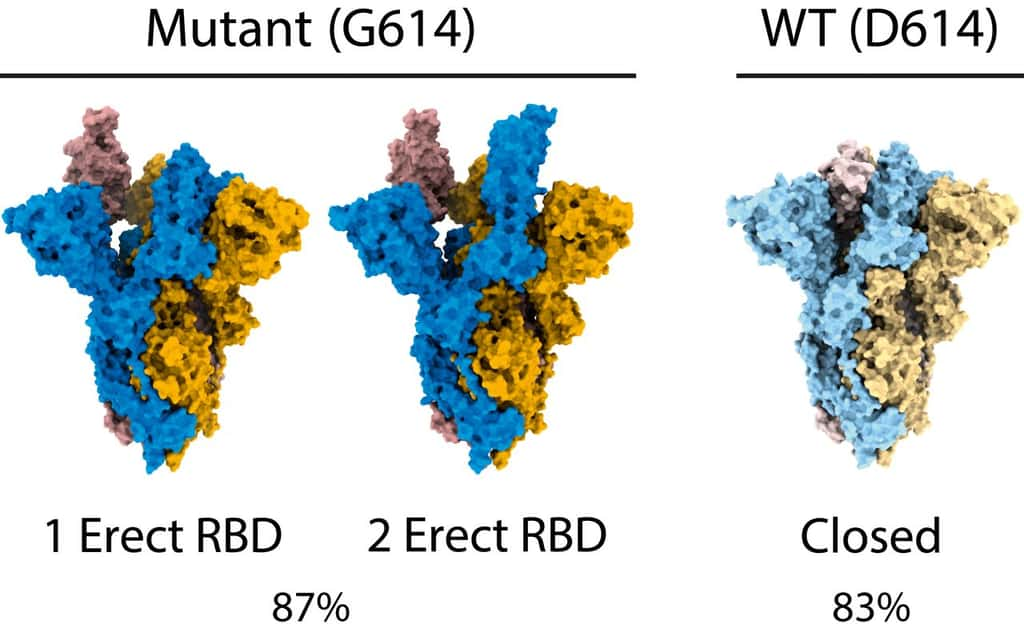
La première est parue il y a quelque jours dans PNAS. Portée par les scientifiques de l'Institut Francis CrickFrancis Crick de Londres, elle indique que la mutation D614G a rendu la protéine S plus flexible, facilitant ainsi son interaction avec le récepteur ACE2 cellulaire. Grâce à une technique microscopique de pointe, la cryo-microscopie électroniquecryo-microscopie électronique, les scientifiques ont observé que la protéine S du mutant adoptait préférentiellement sa forme « ouverte », une forme où les receptor binding domain sont accessibles et prêts à interagir avec ACE2.
Au contraire, la protéine S de la souche non mutée est sous sa forme « fermée », où les receptor binding domain (RBD) sont masqués. Selon les scientifiques, cela explique la meilleure infectiosité de D614G.
Une mutation qui la renforce
Dans une seconde étude, parue dans eLife, les scientifiques de plusieurs centres de recherche de New York se sont posé la même question et sont parvenus à une conclusion différente. Ces derniers ont utilisé une technique d'interférométrieinterférométrie bi-couche, une technique qui permet d'étudier l'interaction entre deux moléculesmolécules, pour mesurer la constante de dissociation entre la protéine S et le récepteur ACE2. Celle-ci est plus importante pour la souche D614G que pour la souche non mutée. Cela témoigne d'une interaction plus solidesolide et plus durable entre le virus et son récepteur.
De plus, ils ont montré que la protéine S mutée résiste mieux aux attaques des protéasesprotéases lorsque les virionsvirions s'assemblent à l'intérieur des cellules. Ainsi, à leur sortie de la cellule, les virions D614G disposent de plus de protéines S fonctionnelles à leur surface que les souches ne possédant pas cette mutation.
Ces deux études proposent donc deux raisons différentes, mais pas forcément opposées, aux succès épidémiologiques de D614G. Tout cela pourrait bien être utile aux scientifiques pour comprendre le succès d'autres mutations, comme celles portées par les variants anglais et sud-africain. Pour le moment, les scientifiques ont confirmé qu'ils sont plus infectieux que D614G mais les raisons demeurent mystérieuses.